

 Principal |
Mapa do Site |
Adicione aos Favoritos |
Indique o site |
Contato
Principal |
Mapa do Site |
Adicione aos Favoritos |
Indique o site |
Contato

|

 Principal |
Mapa do Site |
Adicione aos Favoritos |
Indique o site |
Contato
Principal |
Mapa do Site |
Adicione aos Favoritos |
Indique o site |
Contato
|
| A Farmabrasilis | O que Fazemos | Pesquisa e Desenvolvimento | Publicações e Monografias | Ensaios Clinicos | Notícias | Contato |
 |

27/09/2008
O modelo tumoral
O carcinoma renal murino (RENCA) surgiu espontaneamente em camundongos BALB/c e foi originalmente isolado pela Dra. Sarah Stewart no National Cancer Institute nos Estados Unidos e, em seguida, seu crescimento foi caracterizado em animais singênicos (Murphy e Hrushesky, 1980; Williams et al., 1981.
O RENCA é um tumor de imunogenicidade baixa a moderada que pode ser injetado no sítio ortotópico, tornando-se altamente vascularizado durante seu desenvolvimento, podendo invadir localmente e formar metástases em linfonodos regionais, pulmões e fígado (Murphy e Hrushesky, 1973).
Seu crescimento progressivo a partir do sítio ortotópico de maneira similar ao descrito para o câncer renal humano permite considerá-lo um dos principais modelos para avaliação de abordagens quimio e imunoterapêuticas ao tratamento do câncer renal (Wiltrout, 1993; Wigginton e Wiltrout, .
O RENCA pode ser transplantado para uma variedade de sítios anatômicos, dependendo do tipo de abordagem terapêutica a ser .
As vias de inoculação subcutânea (s.c.), intradérmica (i.d.), intraperitoneal (i.p.) e intrarrenal (i.r.) são amplamente empregadas para a inoculação das células .
Em geral, as velocidades de crescimento dos tumores primários resultantes são similares, com exceção do tumor i.p. que apresenta um desenvolvimento mais rápido em relação aos demais.
Da mesma forma, o tempo de sobrevida dos camundongos inoculados i.p. é ligeiramente menor, em torno de 28-32 dias, do que o determinado para as outras vias de inoculação (35-45 dias) (Wiltrout, 1993).
No modelo RENCA, diferentes abordagens terapêuticas podem ser avaliadas contra a doença progressivamente mais avançada e contra a doença localizada em diferentes órgãos bem como quando o tumor primário cresce no rim e depois se dissemina espontaneamente para outros .
Entretanto, esse tipo de experimento exige habilidades cirúrgicas. Os animais podem ser tratados com o tumor primário ainda presente no rim.
Aproximadamente 7 dias após a inoculação tumoral, o tumor começa a invadir localmente e, a partir do dia 11, as metástases começam a aparecer.
Em alguns experimentos realiza-se a ressecção do tumor primário (nefrectomia) previamente ao uso de quimioterapia e/ou imunoterapia para tratar a doença residual disseminada.
A localização do tumor primário no rim torna a sua ressecção relativamente simples e mimetiza a situação clínica de um paciente portador de tumor renal que tem seu órgão retirado (nefrectomia) previamente ao tratamento da fase metastática da doença (Wiltrout, 1993).
O RENCA espontaneamente invade os pulmões a partir de um implante i.r.; um aspecto bastante interessante uma vez que os pulmões são um dos alvos principais de metástase no câncer renal humano. Durante o crescimento progressivo de um implante i.r. de células RENCA também podem ser observadas metástases hepáticas.
De fato, esse modelo também é usado para o estudo de metástases hepáticas pois, a formação de metástases neste órgão é freqüente durante a progressão de vários tipos de câncer humano, inclusive o renal.
Por outro lado, a injeção de células RENCA através da via intravenosa (i.v.) induz a formação de metástases pulmonares, enquanto que a injeção intra-esplênica, leva à formação de metástases hepáticas.
A grande vantagem desses experimentos para avaliação de abordagens terapêuticas é a reprodutibilidade com relação ao crescimento do tumor e a duração relativamente curta do experimento.
No entanto, a principal desvantagem é o estado clínico aparentemente estável em que se encontra o camundongo hospedeiro quando se inicia a terapia, geralmente 3-10 dias após a injeção do tumor (Wiltrout, 1993).
• P-MAPA - Efeito em Carcinoma Renal Murino (R.E.N.C.A.)
Protocolo experimental
Animais inoculados i.r. com células RENCA e tratados i.p. com P-MAPA após nefrectomia. Como controle positivo utilizou-se a Interleucina 2 (IL-2) e Interleucina 12 (IL-12).
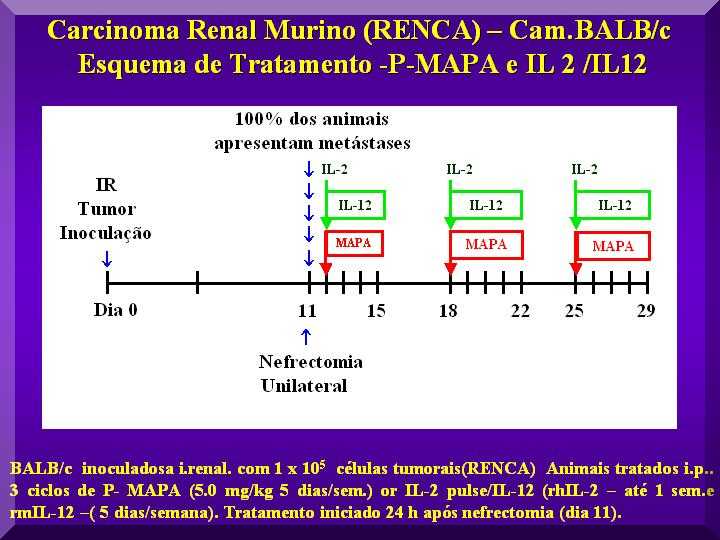
Nesse experimento utilizou-se a via i.r. de inoculação de células RENCA em camundongos e o procedimento de nefrectomia para avaliar o efeito do tratamento com P-MAPA, simulando as condições do câncer renal em pacientes pós-cirurgia.
Assim, foi utilizada uma faixa de doses de P-MAPA e não somente a dose ótima estabelecida em estudos anteriores (Justo et al., 2000, 2003).
Os animais foram inoculados i.r. com 1 x 105 células RENCA em 0,1 mL (dia 0) e no 11º dia, realizou-se a nefrectomia do rim no qual as células tumorais haviam sido injetadas.
No dia seguinte, iniciou-se o tratamento i.p. dos animais com doses de P-MAPA na faixa de 0,1 - 10,0 mg kg-1 em 0,2 mL 5 vezes por semana por 3 ciclos semanais.
Não foram observados sintomas clínicos aparentes de toxicidade em nenhuma das doses utilizadas.
Resultados
O tratamento do grupo controle positivo (IL-2/IL-12) resultou em 40% de sobrevida.
Dentre as doses de P-MAPA testadas, verifica-se que a dose de P-MAPA que apresentou atividade estatisticamente significativa em relação ao controle negativo (p = 0,0025) foi a de 5,0 mg kg-1 (0,5 mg/kg)sendo que resultados obtidos para as doses de 1,0 e 2,5 mg kg-1 não foram estatisticamente diferentes do controle negativo
Esses resultados corroboram com trabalhos anteriores que descreveram como dose ótima em camundongos, a dose de 5 mg kg-1 (Justo et al., 2000, 2003).
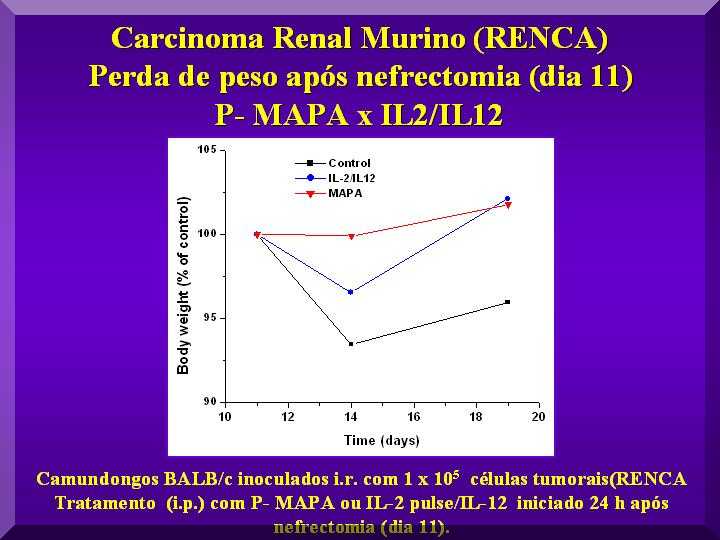
Devido à realização de procedimento cirúrgico, o peso dos animais foi monitorado desde o dia que antecedeu à cirurgia (nefrectomia) até o 19o dia após a cirurgia.
Enquanto os animais do grupo controle negativo não recuperaram o peso após a cirurgia, os animais tratados com as diferentes doses de P-MAPA e com IL-2/IL-12 restabeleceram seus pesos.
Todos os grupos apresentaram uma maior perda de peso nos 5 dias que sucederam a nefrectomia, conforme esperado para um período pós-operatório
O grupo que apresentou menor variação de peso nesse período (0,1 % em relação ao controle) foi o grupo tratado com 5,0 mg kg-1 de P-MAPA, indicando um melhor estado geral dos animais.
Número de metástases
Após o óbito de cada animal, realizou-se necrópsia para avaliação macroscópica da distribuição de metástases em todos os animais. As metástases foram classificadas segundo a escala de 5 pontos e os resultados expressos em porcentagem de animais portadores de metástases de intensidade definida.
O gráfico apresenta os resultados de metástases abdominais, pulmonares e hepáticas encontradas nos animais do grupo controle negativo e do grupo tratado com 5,0 mg kg-1 de PMAPA. ( Para visualizar clique nesta linha ).
Gráfico: Análise das metástases de animais inoculados i.r. com RENCA após tratamento i.p. com 5,0 mg kg-1 de P-MAPA ou solução veículo após nefrectomia
Escala de pontos -(critérios): a)Porcentagem de animais portadores de metástases (%),b)Metástases abdominais, Metástases pulmonares, Metástases hepáticas.
De acordo com o gráfico é possível observar uma redução no número de metástases hepáticas e pulmonares após a administração de 5,0 mg kg-1 de P-MAPA aos animais.
No entanto, esse efeito não foi observado quando foram analisadas as metástases abdominais.
Ao contrário, os dados indicam um aumento no grupo tratado em relação ao grupo controle negativo.
Conforme descrito na literatura, em animais não tratados não é observada a formação de nenhum tipo de metástase até o estágio II da doença (em torno do 15o dia após inoculação do tumor).
No período entre os dias 22-24 após inoculação do tumor, classificado como estágio III da doença, quase a totalidade dos animais apresenta metástases nos linfonodos abdominais.
No entanto, metástases pulmonares e hepáticas só são observadas no estágio IV da doença, após 24 dias de inoculação do tumor (Salup et al., 1985; 1987).
Conclusões
Os resultados obtidos neste experimento sugerem a possibilidade do P-MAPA prevenir a formação de metástases pulmonares e hepáticas neste modelo experimental e contribuir para uma melhora clínica dos animais em estágio IV, ou seja, em estágio bastante avançado da doença.
A utilização do P-MAPA no tratamento de doença residual do carcinoma renal é promissora, inclusive como composto a ser empregado em terapias combinadas.


Política de Privacidade | Termo de Uso |
copyright @2006 - farmabrasilis - todos os direitos reservados
|